Основные показатели состава и качества воды
Минерализация
Суммарное содержание всех найденных при химическом анализе воды минеральных веществ; обычно выражается в мг/дм3 (до 1000 мг/дм3) и ‰ (более 1000 мг/дм3).
Минерализация природных вод, определяющая их удельную электропроводность, изменяется в широких пределах. Большинство рек имеет минерализацию от нескольких десятков миллиграммов в литре до нескольких сотен. Их удельная электропроводность варьирует от 30 мкСм/см до 1500 мкСм/см. Минерализация подземных вод и соленых озер изменяется в интервале от 40-50 мг/дм3 до 650 г/кг (плотность в этом случае уже значительно отличается от единицы). Удельная электропроводность атмосферных осадков (с минерализацией от 3 до 60 мг/дм3) составляет величины 20-120 мкСм/см.
Классификация природных вод по минерализации.
| Категория вод |
Минерализация, г/дм3
|
| Ультрапресные |
< 0.2 |
| Пресные |
0.2 - 0.5 |
| Воды с относительно повышенной минерализацией |
0.5 - 1.0 |
| Солоноватые |
1.0 - 3.0 |
| Соленые |
3 - 10 |
| Воды повышенной солености |
10 - 35 |
| Рассолы |
> 35 |
Очень часто параметр «общая минерализация» путают с «сухим остатком». Действительно, эти параметры очень близки между собой, но методика определения сухого остатка несколько иная. Это приводит к тому, что общая минерализация зачастую отличается от сухого остатка. Сухой остаток определяется термогравиметрическим методом (выпаривание пробы воды на водяной бане и высушивания чашки при 105 °С.) В процессе обработки из пробы удаляются летучие компоненты и вещества, разлагающиеся с образованием летучих компонентов.
В соответствии с гигиеническими требованиями к качеству питьевой воды суммарная минерализация не должна превышать величины 1000 мг/л. Вода, содержащая большое количество солей, отрицательно влияет на растения и человека, вызывает образование накипи на стенках котлов, коррозию, засоление почв. Регулярное употребление высокоминерализованной воды ведет к болезням пищеварения, обмена веществ, повышенной сухости кожи.
Взвешенные вещества (грубодисперсные примеси)
Взвешенные твердые вещества, присутствующие в природных водах, состоят из частиц глины, песка, ила, суспендированных органических и неорганических веществ, планктона и различных микроорганизмов. Концентрация взвешенных частиц связана с сезонными факторами и режимом стока, зависит от пород, слагающих русло, а также от антропогенных факторов, таких как сельское хозяйство, горные разработки и т.п.
Взвешенные частицы могут приводить к авариям в системе водоснабжения, прозрачность (или мутность) воды, на скорость осадкообразования и теплообмен в котельных установках. Повышенное содержание взвесей способно приводить к авариям в водопроводной системе. Вода, в которой много взвешенных частиц, не подходит для использования по эстетическим и хозяйственно-бытовым соображениям. Грубодисперсные примеси определяют гравиметрическим методом.
Мутность (тонкодисперсные примеси)
Мутность природных вод вызвана присутствием тонкодисперсных примесей, обусловленных нерастворимыми или коллоидными неорганическими и органическими веществами различного происхождения. Взвешенные вещества попадают в воду в результате смыва твердых частичек (глины, песка, ила) верхнего покрова земли дождями или талыми водами во время сезонных паводков, а также в результате размыва русла рек. Наименьшая мутность водоемов наблюдается зимой, наибольшая - весной (в период паводков) и летом (в период дождей). Также повышение мутности воды может быть вызвано взвесями карбонатов, гидроксидов алюминия, высокомолекулярных органических примесей гумусового происхождения, появлением фито- и изопланктона, а также окислением соединений железа и марганца кислородом воздуха.
Взвешенные вещества имеют различный гранулометрический состав, который характеризуется гидравлической крупностью, выражаемой как скорость осаждения частиц при температуре 10 oС в неподвижной воде.
| Взвешенные вещества |
Размер, мм |
Скорость осаждения, мм/с |
Время осаждения частиц на глубину 1 м |
| Коллоидные частицы |
2×10-4 …1×10-6
|
7×10-6
|
4 года |
| Тонкая глина |
1×10-3 …5×10-4
|
7×10-4 - 17×10-5
|
0.5 - 2 месяца |
| Глина |
27×10-4
|
5×10-3
|
2 суток |
| Ил |
5×10-2- 27×10-3
|
1.7 - 0.5 |
10 - 30 минут |
| Песок мелкий |
0.1 |
7 |
2.5 минуты |
| Песок средний |
0.5 |
50 |
20 с |
| Песок крупный |
1.0 |
100 |
10 с |
Качественное определение проводят описательно: слабая опалесценция, опалесценция, слабая, заметная и сильная муть.
Мутность воды определяют турбидиметрически по ослаблению проходящего через пробу света (РД 52.08.104-2002 Методические указания. Мутность воды. Методика выполнения измерений.) путем сравнения проб исследуемой воды со стандартными суспензиями. Результаты измерений выражают в мг/л (при использовании основной стандартной суспензии каолина) или в ЕМФ/л (единицы мутности на л при использовании основной стандартной суспензии формазина); 1,5 мг/л каолина соответствует 2,6 ЕМФ/л формазина. Турбидиметрическое определение предназначено для вод, имеющих переменчивый состав и форму тонкодисперсных примесей. Если пробу предварительно не профильтровать, то турбидиметрически будут определены не только коллоидные, но и более грубодисперсные частицы.
Мутность не только отрицательно влияет на внешний вид воды. Главным отрицательным следствием высокой мутности является то, что она защищает микроорганизмы при ультрафиолетовом обеззараживании и стимулирует рост бактерий. Поэтому во всех случаях, когда производится дезинфекция воды, мутность должна быть минимальной для обеспечения высокой эффективности этой процедуры. В соответствии с гигиеническими требованиями к качеству питьевой воды мутность не должна превышать 1,5 мг/л по каолину. (Каолин в основном состоит из каолинита, который представляет собой кристаллическое вещество состава Al2O3×2SiO2×2H2O. Глины или совсем не содержат этого соединения или содержат его как случайную примесь. Чистый каолин – белого цвета и отличается сравнительно малой пластичностью. Ввиду того, что он служит сырьём для изготовления фарфора, его называют фарфоровой землёй).
Запах и привкус
Запах – это свойство воды вызывать у человека и животных специфическое раздражение слизистой оболочки носовых ходов. Запах воды характеризуется интенсивностью, которую измеряют в баллах. Запах воды вызывают летучие пахнущие вещества, поступающие в воду в результате процессов жизнедеятельности водных организмов, при биохимическом разложении органических веществ, при химическом взаимодействии содержащихся в воде компонентов, а также с промышленными, сельскохозяйственными и хозяйственно-бытовыми сточными водами.
На запах воды оказывают влияние состав содержащихся в ней веществ, температура, значения рН, микроорганизмы, гидрологические условия и т.д. Концентрации различных веществ, при которых ощущается их запахи или привкус в воде, неодинаковы. Сероводород ощущается при концентрации его в воде более 0.2-0.3 мг/л, хлор - при концентрации более 0.3 мг/л, хлорфенол - при концентрации более 0.02 мг/л, продукты жизнедеятельности актиномицетов (придают воде землистый запах) ощущаются при концентрации более 10-8 мг/л.
Определение интенсивности запаха воды:
| Оценка интенсивности запаха, баллы |
Интенсивность запаха |
Характер проявления запаха |
| 0 |
никакого запаха |
отсутствие ощутимого запаха |
| 1 |
очень слабый |
запах, не замечаемый потребителем, но обнаруживаемый специалистом |
| 2 |
слабый |
запах, обнаруживаемый потребителем, если обратить на это внимание |
| 3 |
заметный |
запах, легко обнаруживаемый, может быть причиной того, что вода неприятна для питья |
| 4 |
отчетливый |
запах, обращающий на себя внимание, может заставить воздержаться от питья |
| 5 |
запах, обращающий на себя внимание, может заставить воздержаться от питья |
запах, настолько сильный, что делает воду непригодной для питья |
Химически чистая вода совершенно лишена вкуса. Однако в природе такая вода не встречается – она всегда содержит в своем составе растворенные вещества. По мере роста концентрации неорганических и органических веществ, вода начинает принимать тот или иной привкус. Вкус – это свойство веществ (в нашем случае воды) вызывать у человека и животных специфическое раздражение рецепторов слизистой оболочки языка. Следует также иметь в виду, что привкус может появиться в воде на нескольких этапах: в природной воде, в процессе водоподготовки, при транспортировке по трубопроводам. Различают четыре основных вида вкуса: соленый, кислый, сладкий, горький. Все другие виды вкусовых ощущений называются привкусами (щелочной, металлический, вяжущий и т.п.). Интенсивность вкуса и привкуса определяют при 20 °С и оценивают по пятибалльной системе:
| Оценка интенсивности, балл |
Интенсивность вкуса |
Интенсивность вкуса |
| 0 |
Нет |
Вкус и привкус не ощущаются |
| 1 |
Очень слабая |
Вкус и привкус не ощущаются потребителем но обнаруживаются при лабораторном исследовании |
| 2 |
Слабая |
Вкус и привкус замечаются потребителем, если обратить на это его внимание
|
| 3 |
Заметная |
Вкус и привкус легко замечаются и вызывают неодобрительный отзыв о воде
|
| 4 |
Отчетливая |
Вкус и привкус обращают на себя внимание и заставляют воздержаться от питья
|
| 5 |
Очень сильная |
Вкус и привкус настолько сильные, что делают воду непригодной к употреблению
|
Основными причинами возникновения привкуса и запаха в воде являются:
- 1. Гниющие растения. При недостаточной циркуляции водоема водоросли и водные растения в процессе гниения могут взывать рыбный, травяной, гнилостный запах воды.
- 2. Микробиологическое загрязнение. В почве, грунтовых водах и водоемах живет множество микроорганизмов. Микроорганизмы вызывают возникновение плесневого, землистого или затхлого запаха и привкуса. Тенденция к размножению этих микроорганизмов возникает в местах застоя воды и там, где вода приобретает комфортную для развития температуру (например, в системах горячего водоснабжения больших зданий с накопительными емкостями).
- 3. Железистые и сернистые бактерии. Оба типа бактерий выделяют продукты жизнедеятельности, которые при разложении создают неприятный запах и привкус.
- 4. Растворенные газы. Образуются в результате жизнедеятельности почвенных бактерий и биохимического окисления органических остатков (в основном это аммиак, сероводород и метан).
- 5. Повышенная минерализация воды.
- 6. Железо, марганец, медь, цинк. Продукты коррозии этих металлов придают воде характерный резкий привкус.
- 7. Поваренная соль. В небольших концентрациях придает воде определенный вкус, которые многие люди считают даже привычным. Однако с ростом концентрации приводит к возникновению солоноватого, а затем и резко соленого вкуса.
- 8. Промышленные отходы. Многие вещества, содержащиеся в сточных водах промышленного производства, могут вызвать сильный лекарственный или химический запах воды. Например, проблемой являются фенольные соединения.
Хлорирование воды. При правильном использовании активный хлор не вызывает возникновения сколько-нибудь заметного запаха или привкуса. Появление же такого запаха/привкуса свидетельствует о передозировке при хлорировании. В то же время, хлор способен вступать в химические реакции с различными растворенными в воде веществами, образуя при этом соединения, которые собственно и придают воде хорошо известный многим запах и привкус «хлорки».
Цветность
Показатель качества воды, характеризующий интенсивность окраски воды и обусловленный содержанием окрашенных соединений; выражается в градусах платиново-кобальтовой шкалы. Определяется путем сравнения окраски испытуемой воды с эталонами. Цветность природных вод колеблется от единиц до тысяч градусов. Предельно допустимая величина цветности в водах, используемых для питьевых целей, составляет 20 градусов. Цветность природных вод обусловлена главным образом присутствием гумусовых веществ и соединений железа. Количество этих веществ зависит от геологических условий, водоносных горизонтов, характера почв, наличия болот и торфяников в бассейне реки и т.п. Сточные воды некоторых предприятий также могут создавать довольно интенсивную окраску воды.
Различают «истинный цвет», обусловленный только растворенными веществами, и «кажущийся» цвет, вызванный присутствием в воде коллоидных (размером менее 1 мкм, 1 мкм = 0,001 мм) взвешенных частиц, соотношения между которыми в значительной мере определяются величиной pH.
Высокая цветность воды, как правило, связана с присутствием в ней ионов железа и/или органических примесей и оказывает отрицательное влияние на эстетические ощущения, здоровье человека и животных.
Прозрачность
Прозрачность (или светопропускание) природных вод обусловлена их цветом и мутностью, т.е. содержанием в них различных окрашенных и взвешенных органических и минеральных веществ. Воду в зависимости от степени прозрачности условно подразделяют на прозрачную, слабоопалесцирующую, опалесцирующую, слегка мутную, мутную, сильно мутную.
Мерой прозрачности служит высота столба воды, при которой можно наблюдать опускаемую в воду белую пластину определенных размеров (диск Секки) или различать на белой бумаге шрифт определенного размера и типа (как правило, шрифт средней жирности высотой 3,5 мм). Результаты выражаются в сантиметрах с указанием способа измерения.
Водородный показатель (рН)
Водородный показатель характеризует концентрацию свободных ионов водорода в воде. Для удобства отображения был введен специальный показатель, названный рН и представляющий собой логарифм концентрации ионов водорода, взятый с обратным знаком, т.е. pH = -log[H+]. Например, если концентрация водородных ионов [Н+] =10-5 г-ион/л, то рН = 5.
Величина рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. Если в воде пониженное содержание свободных ионов водорода, по сравнению с ионами ОН-, то рН>7 и вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ вода будет иметь кислую реакцию и рН > 7. В чистой дистиллированной воде эти ионы будут уравновешивать друг друга. В случаях равновесия ионов Н+ и ОН- вода нейтральна и рН=7. При растворении в воде различных химических веществ этот баланс может быть нарушен, что приводит к изменению уровня рН. Очень часто показатель рН путают с такими параметрами, как кислотность и щелочность воды. Важно понимать разницу между ними. Главное заключается в том, что рН – это показатель интенсивности, но не количества. То есть, рН отражает степень кислотности или щелочности среды, в то время как кислотность и щелочность характеризуют количественное содержание в воде веществ, способных нейтрализовывать соответствующее количество щелочи или кислоты.
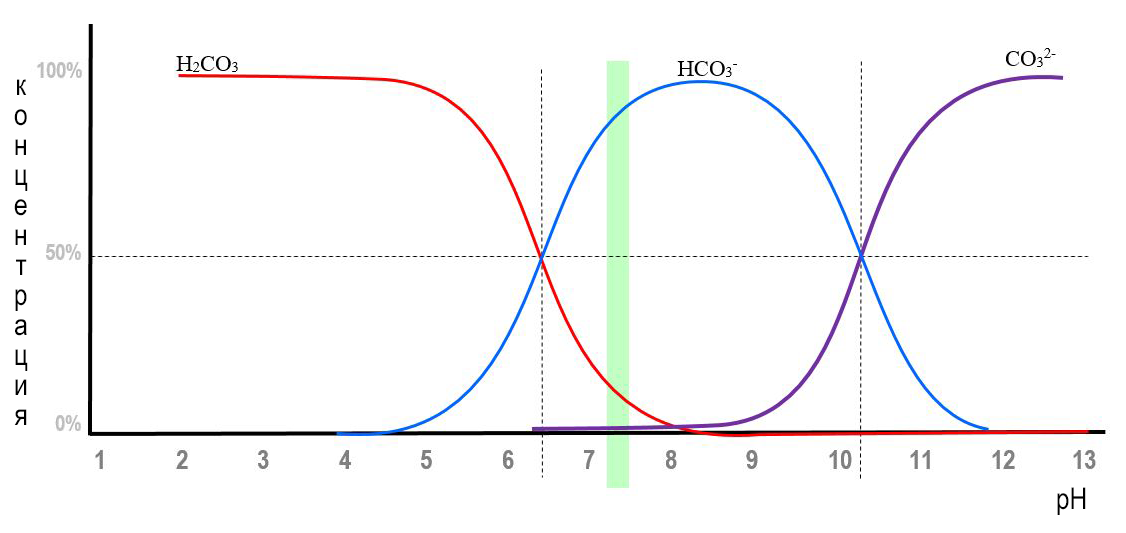
Концентрация водородных ионов определяет соотношение между бикарбонатными HCO32- и карбонатными CO32- ионами (рис.).
Источником ионов водорода являются также гумусовые кислоты, присутствующие в почвах. Изменения pH тесно связаны с процессами гидролиза, например гидролизом солей металлов: Fe2+ + 2H2O ↔ Fe(OH)2- + 2H+.
От величины pH зависит развитие и жизнедеятельность многих организмов, устойчивость различных форм миграции элементов, агрессивное действие воды на металлы и бетон. Величина pH воды также влияет на процессы превращения различных форм биогенных элементов, изменяет токсичность загрязняющих веществ. Например, увеличение присутствия в воде анионов ОН- уменьшает растворимость металлов, т.к. большинство гидоксидов металлов трудно растворимы.
Природные воды в зависимости от рН рационально делить на семь групп:
| Группа |
рН |
Примечание |
| Сильнокислые воды |
< 3 |
результат гидролиза солей тяжелых металлов (шахтные и рудничные воды) |
| Кислые воды |
3..5 |
поступление в воду угольной кислоты, фульвокислот и других органических кислот в результате разложения органических веществ |
| Слабокислые воды |
5..6,5 |
присутствие гумусовых кислот в почве и болотных водах (воды лесной зоны) |
| Нейтральные воды |
6,5..7,5 |
наличие в водах Ca(HCO3)2, Mg(HCO3)2
|
| Слабощелочные воды |
7,5..8,5 |
наличие в водах Ca(HCO3)2, Mg(HCO3)2
|
| Щелочные воды |
8,5..9,5 |
присутствие Na2CO3 или NaHCO3
|
| Сильнощелочные воды |
9,5 |
присутствие Na2CO3 или NaHCO3
|
В соответствии с требованиями к составу и свойствам питьевой воды, величина pH не должна выходить за пределы интервала значений 6,0..9,0. Контроль уровня рН особенно важен на всех стадиях водоочистки, так как его «уход» в ту или иную сторону может не только существенно сказаться на запахе, привкусе и внешнем виде воды, но и повлиять на эффективность водоочистных мероприятий. рН теоретически находится в диапазоне 1..14. Значение pH в речных водах обычно варьирует в пределах 6,5..8,5, в атмосферных осадках 4,6..6,1, в болотах 5,5..6,0, в морских водах 7,9..8,3. Концентрация ионов водорода подвержена сезонным колебаниям. Зимой величина pH для большинства речных вод составляет 6,8..7,4, летом 7,4..8,2 При низком рН вода обладает высокой коррозионной активностью, а при высоких уровнях (рН>11) вода приобретает характерную мылкость, неприятный запах, вызывает раздражение глаз и кожи. Для быстрого (сигнального) анализа неизвестных растворов используется рН-индикаторная бумага, имеющая точность определения рН не более ±1, что недостаточно для выполнения анализа природной и питьевой воды.
Растворенный кислород
Растворенный кислород находится в природной воде в виде молекул O2. В 100 объемах H2O растворяется 3 объема O2 (при норм. условиях, т.е. при давлении 1 атм. и температуре 20 oС). На его содержание в воде влияют две группы противоположно направленных процессов: одни увеличивают концентрацию кислорода, другие уменьшают ее. К первой группе процессов, обогащающих воду кислородом, следует отнести:
- 1. Процесс абсорбции кислорода из атмосферы; Абсорбция кислорода из атмосферы происходит на поверхности водного объекта. Скорость этого процесса повышается с понижением температуры, с повышением давления и понижением минерализации. Обогащение глубинных слоев воды кислородом происходит в результате перемешивания водных масс, в том числе ветрового, вертикальной температурной циркуляции и т.д.
- 2. Выделение кислорода водной растительностью в процессе фотосинтеза; Фотосинтетическое выделение кислорода происходит при ассимиляции диоксида углерода водной растительностью. Процесс фотосинтеза протекает тем сильнее, чем выше температура воды, интенсивность солнечного освещения и больше биогенных (питательных) веществ (P, N и др.) в воде. Продуцирование кислорода происходит в поверхностном слое водоема, глубина которого зависит от прозрачности воды.
- 3. Поступление в водоемы с дождевыми и снеговыми водами, которые обычно пересыщены кислородом.
К группе процессов, уменьшающих содержание кислорода в воде, относятся реакции потребления его на окисление:
- 1. биологическое (дыхание организмов)
- 2. биохимическое (дыхание бактерий, расход кислорода при разложении органических веществ)
- 3. химическое (окисление Fe2+, Mn2+, NO2-, NH44+, CH4, H2S).
Скорость потребления кислорода увеличивается с повышением температуры, количества организмов и веществ, подвергающихся химическому и биохимическому окислению.
В поверхностных водах содержание растворенного кислорода варьируется в широких пределах – от 0 до 14 мг/л и подвержено сезонным и суточным колебаниям. Суточные колебания зависят от интенсивности процессов его продуцирования и потребления и могут достигать 2,5 мг/л растворенного кислорода. В зимний и летний количество кислорода в воде различается. Дефицит кислорода чаще наблюдается в водных объектах с высокими концентрациями загрязняющих органических веществ и в водоемах, содержащих большое количество биогенных и гумусовых веществ.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого и санитарного водопользования содержание растворенного кислорода в пробе, отобранной до 12 часов дня, не должно быть ниже 4 мг/л в любой период года; для водоемов рыбохозяйственного назначения концентрация растворенного в воде кислорода не должна быть ниже 4 мг/л в зимний период и 6 мг/л в летний.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого и санитарного водопользования содержание растворенного кислорода в пробе, отобранной до 12 часов дня, не должно быть ниже 4 мг/л в любой период года; для водоемов рыбохозяйственного назначения концентрация растворенного в воде кислорода не должна быть ниже 4 мг/л в зимний период и 6 мг/л в летний.
Содержание кислорода в водоемах с различной степенью загрязненности:
| Уровень загрязненности воды и класс качества |
Растворенный кислород |
| |
лето, мг/л |
зима, мг/л |
% насыщения |
| Очень чистые, I |
9 |
14..13 |
95 |
| Чистые, II |
8 |
12..11 |
80 |
| Умеренно загрязненные, III |
7..6 |
10..9 |
70 |
| Загрязненные, IV |
5..4 |
5..4 |
60 |
| Грязные, V |
3..2 |
5..1 |
30 |
| Очень грязные, VI |
0 |
0 |
0 |
Низкое содержание растворенного кислорода в системах водоснабжения может способствовать увеличению содержания растворенного неорганического железа, а также микробиологическому восстановлению нитрата в нитрит и сульфата в сульфид, что вызывает появление запаха. Уменьшение количества кислорода приводит также к повышению концентрации двухвалентного железа в растворе и осложняет его удаление. В то же время высокое содержание растворенного кислорода придает воде коррозионные свойства по отношению к металлам и бетону.
Жесткость
Жесткость воды представляет собой свойство природной воды, зависящее от наличия в ней главным образом растворенных солей кальция и магния. Суммарное содержание этих солей называют общей жесткостью. Общая жесткость подразделяется на:
- 1. Карбонатную. Карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. При кипячении гидрокарбонаты разрушаются с образованием осадков малорастворимых карбонатов, например: Сa2+ + 2HCO3- → CaCO3↓ + CO2↑+ H2O; Mg2+ + 2HCO3- → Mg(OH)2↓ + 2CO2↑; и общая жесткость уменьшается, поэтому карбонатную жесткость называют также временной или устранимой.
- 2. Некарбонатную, обусловленную кальциевыми и магниевыми солями сильных кислот (сульфаты и хлориды кальция и магния). Оставшаяся после кипячения жесткость является некарбонатной и называется постоянной.
Результаты определения жесткости обычно выражают в мг-экв/л. В следующей таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они ассоциируются:
| Катионы |
Анионы |
| Кальций (Сa2+) |
Гидрокарбонат (HCO3-), Сульфат (SO42-), Хлорид (Cl-) |
| Магний (Mg2+) |
Гидрокарбонат (HCO3-), Сульфат (SO42-), Хлорид (Cl-) |
| Стронций (Sr2+) |
Хлорид (Cl-) |
| Железо (Fe2+) |
Нитрат (NO3-) |
Марганец (Mn2+
| Силикат (SiO32-
| |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость, и, соответственно, «вклад» в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+). Жесткость воды колеблется в широких пределах.
| Уровень жесткости, мг-экв/л |
Мягкость воды |
| <4 |
мягкая |
| 4..8 |
средней жесткости |
| 8..12 |
жесткая |
| >12 |
очень жесткая |
Физиологически оптимально для человека пить воду с жесткостью 2,5..3,0 мг-экв/л. Особые требования предъявляются к технической воде (из-за образования накипи) – в диапазоне 0,5..0,7 мг-экв/л.
В естественных условиях ионы кальция и магния, составляющих жесткость, поступают в воду в результате взаимодействия растворенного диоксида углерода с карбонатными минералами и других процессов растворения и химического выветривания горных пород. Источником этих ионов являются также микробиологические процессы, протекающие в почвах. Обычно преобладает жесткость, обусловлена ионами кальция (до 70%); однако в отдельных случаях магниевая жесткость может достигать 50..60%. Жесткость морской воды и океанов значительно выше (десятки мг-экв/л). Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья.
В мировой практике используется несколько единиц измерения жесткости, все они определенным образом соотносятся друг с другом. В России Госстандартом в качестве единицы жесткости воды установлен моль на кубический метр (моль/м3). Один моль на кубический метр соответствует массовой концентрации эквивалентов ионов кальция (Ca2+) 20,04 г/м3 (мг/л) или ионов магния (Mg2+) 12,153 г/м3 (мг/л). Числовое значение жесткости, выраженное в молях на кубический метр равно числовому значению жесткости, выраженному в миллиграмм- эквивалентах на литр (или кубический дециметр), т.е. 1 моль/м3 = 1 ммоль/л = 1 мг-экв/л = 1 мг-экв/дм3. В зарубежных странах широко используются такие единицы жесткости, как немецкий градус (do, dH), французский градус (fo), американский градус (ppm CaCO3).
Основные единицы жесткости воды и их соотношение:
| Моль/м3(мг-экв/л) |
Немецкий градус, do |
Французский градус, fo |
Английский градус |
Американский градус |
gpg (grain per gallon, или грэйн/галлон) |
ppm (мг/л) СаСО3 |
| 1.000 |
2.804 |
5.005 |
3.511 |
50.050 |
2.920 |
50.050 |
Концентрации ионов могут быть выражены в эквивалентах на литр (моль-экв/л), числом моль на литр (моль/л) или их массой в любом объеме. В США жесткость измеряют эквивалентно концентрации карбоната кальция в грэйнах, а в качестве единицы жёсткости продолжают использовать грэйн/галлон (gpg), несмотря на то, что в большинстве стран эта единица измерения считается устаревшей. Американский галлон равен 3,78533 литра, грейн (Grain или gr.) равен 0,0648 г, отсюда 1 грэйн/галлон = 17,1187 мг/л (17,1187 ppm) ≈ 17,12 мг/л. Немецкий градус жесткости соответствует раствору с концентрацией CaO 10 мг/л, английский – раствору с концентрацией CaСO3 14,25 мг/л [1 грэйн (0,0648 г) на имперский галлон (4,546 л)], французский – раствору с концентрацией CaСO3 10 мг/л, а американский – раствору с концентрацией CaСO3 1 мг/л. Т.е. за базу (рейперную точку) принимался стандартный раствор CaO или CaCO3.
Повышенная жесткость воды негативно отражается на здоровье человека и его быте:
- 1. Приводит к уменьшению срока службы бытовой техники (водонагревательные приборы) из-за накипи;
- 2. Ухудшаются моющие свойства мыла и стиральных порошков, т.к. при взаимодействии солей жесткости с моющими веществами (мыло, стиральные порошки, шампуни) происходит образование «мыльных шлаков» в виде хлопьев, что препятствует пенообразованию. Это приводит не только к значительному перерасходу моющих средств [см. п.6]
- 3. Жесткость воды – один из факторов, влияющих на образование камней в почках;
- 4. Ухудшаются вкусовые свойства воды из-за горьковатого привкуса; Порог вкуса для иона кальция лежит в диапазоне 2..6 мг-экв/л, в зависимости от соответствующего аниона, а порог вкуса для магния и того ниже; Наилучшие вкусовые свойства имеет вода с жесткостью 1,6..3,0 мг-экв/л;
- 5. Оказывает отрицательное действие на органы пищеварения, волосы и кожу; Главным отрицательным воздействием солей жесткости на человека является то, что они разрушают естественную жировую пленку, которой всегда покрыта нормальная кожа и забивают ее поры. Оказывается, что вызывающее у некоторых раздражение чувство «мылкости» после пользования мягкой водой является признаком того, что защитная жировая пленка на коже цела и невредима. Именно она и скользит. В противном случае, приходится тратиться на лосьоны, умягчающие и увлажняющие кремы и прочие хитрости для восстановления защитной функции кожи. Соли жесткости после высыхания остаются в виде налета на сантехнике, белье, человеческой коже, на волосах (неприятное чувство «жестких» волос, хорошо известное многим).
- 6. Медленно развариваются мясо и овощи;
Всемирная Организация Здравоохранения (ВОЗ) не предлагает какой-либо рекомендуемой величины жесткости по показаниям влияния на здоровье. В материалах ВОЗ говорится о том, что хотя ряд исследований и выявил статистически обратную зависимость между жесткостью питьевой воды и сердечно-сосудистыми заболеваниями, имеющиеся данные не достаточны для вывода о причинном характере этой связи. Аналогичным образом, однозначно не доказано, что мягкая вода оказывает отрицательный эффект на баланс минеральных веществ в организме человека.
Железо (Fе, суммарно)
Железо существует в природе в различных формах (в зависимости от валентности: Fe0, Fe2+, Fe3+), а также в составе различных сложных химических соединений.
- 1. Элементарное железо (Fe0). Элементарное или металлическое железо, безусловно, нерастворимо в воде. В присутствии влаги и кислорода воздуха окисляется до трехвалентного, образуя нерастворимый оксид Fe2O3 (процесс, известный в быту как "ржавление").
- 2. Двухвалентное железо (Fe2+). Почти всегда находится в воде в растворенном состоянии, хотя возможны случаи (при определенных редко встречающихся в природной воде уровнях рН), когда гидроксид железа Fe(OH)2 способен выпадать в осадок.
- 3. Трехвалентное железо (Fe3+). Гидроксид железа Fe(OH)3 нерастворим в воде (кроме случая очень низкого рН). Хлорид (FeCl3) и сульфат (Fe2(SO4)3 трехвалентного железа - растворимы и могут образовываться даже в слабощелочных водах. Реакция Fe2+ ↔ Fe3+ широко распространена в природе.
- 4. Органическое железо. Органическое железо встречается в воде в разных формах и в составе различных комплексов. Органические соединения железа, как правило, растворимы или имеют коллоидную структуру и очень трудно поддаются удалению. Различают следующие виды органического железа:
- 5. Бактериальное железо. Некоторые виды бактерий (например, Gallionella ferruginea, вид стебельчатых, лентоподобных бактерий) способны использовать энергию растворенного железа в процессе своей жизнедеятельности. При этом происходит преобразование двухвалентного железа в трехвалентное, которое сохраняется в желеобразной оболочке вокруг бактерии.
- 6. Коллоидное железо. Коллоиды - это нерастворимые, невидимые глазу частицы очень малого размера (менее 1 микрона), в силу чего они трудно поддаются фильтрации на гранулированных фильтрующих материалах. Крупные органические молекулы (такие как танины и лигнины) также попадают в эту категорию. Коллоидные частицы из-за своего малого размера и высокого поверхностного заряда (отталкивающего частицы друг от друга, препятствуя их укрупнению) создают в воде суспензии и не осаждаются, находясь во взвешенном состоянии. Коллоидное железо характерно для поверхностных вод (коллоиды Fe(OH)3).
- 7. Растворимое органическое железо. Так же как, например, полифосфаты способны связывать и удерживать в растворе кальций и другие металлы, некоторые органические молекулы способны связывать железо в сложные растворимые комплексы, называемые хелатами. Примером такого связывания может служить удерживающая железопорфириновая группа гемоглобина крови или удерживающий магний хлорофилл растений. Так, прекрасными хелатообразующими агентами являются фульво- и гуминовая кислоты, играющия важную роль в почвенном ионообмене.
На практике встречается сочетание нескольких или даже всех видов железа. Все они ведут себя по-разному:
| Тип железа |
Исходная вода |
Вода после отстаивания |
| Двухвалентное |
Чистая |
Красно - бурый осадок |
| Трехвалентное |
Окрашена |
Красно - бурый осадок |
| Коллоидное |
Желто - бурая |
Не образует осадка, не фильтруется |
| Растворенное - органическое |
Желто-бурая |
|
| Бактериальное |
Опалесцирующая пленка, желеобразные образования в водопроводной системе. |
Содержание железа в пресных поверхностных водах составляет десятые доли миллиграмма. Основной его формой в поверхностных водах являются комплексные соединения трехвалентных ионов железа с растворенными неорганическими и органическими соединениями, главным образом с солями гуминовых кислот – гуматами. Поэтому повышенное содержание железа наблюдается в болотных водах (единицы миллиграммов), где концентрация гумусовых веществ достаточно велика. При рН = 8.0 основной формой железа в воде является гидроокись железа Fe(OH)3, находящаяся во взвешенной коллоидной форме. Наибольшие же концентрации железа (до нескольких десятков миллиграмм в 1 л) наблюдаются в подземных водах с низкими значениями рН и с низким содержанием растворенного кислорода, а в районах залегания сульфатных руд концентрации железа могут достигать даже сотен миллиграммов в 1 литре воды. В подземных водах железо присутствует в основном в растворенном двухвалентном виде. Трехвалентное железо при определенных условиях также может присутствовать в воде в растворенном виде как в форме неорганических солей (например, сульфатов), так и в составе растворимых органических комплексов.
Содержащая железо вода (особенно подземная) сперва прозрачна и чиста на вид. Однако даже при непродолжительном контакте с кислородом воздуха железо окисляется, придавая воде желтовато-бурую окраску. Уже при концентрациях железа выше 0,5 мг/л такая вода способна вызвать появление ржавых потеков на сантехнике и пятен на белье при стирке. При содержании железа выше 1 мг/л вода становится мутной, окрашивается в желто-бурый цвет, у нее ощущается характерный металлический привкус. Все это делает такую воду практически неприемлемой как для технического, так и для питьевого применения.
По органолептическим признакам предел содержания железа в воде согласно СанПиН 2.1.4.1074-01 (Питьевая вода.) практически повсеместно установлен на уровне 0,3 мг/л (а по нормам Европейского Сообщества (ЕС) даже 0,2 мг/л). Здесь необходимо подчеркнуть, что это ограничение именно по органолептическим соображениям. По показаниям вредности для здоровья такой параметр не установлен. на организм человека. При уровне установленного ВОЗ (Всемирной организацией здравоохранения) переносимого суточного потребления (ПСП) железа, равном 0.8 мг/кг массы тела человека, безопасное для здоровья суммарное содержание железа в воде составляет 2 мг/л. Это означает, что употребляя ежедневно на протяжении всей жизни такую воду, можно не опасаться за последствия для здоровья (другое дело, что вода с 2 мг/л железа будет иметь весьма «неаппетитный» вид и вкус). Избыток железа, в первую очередь, оказывает токсическое влияние на печень, селезенку, головной мозг, может усиливать протекание воспалительных процессов в организме.
Дефицит железа в организме приводит к анемии, патологиям сердечной мышцы и скелетных мышц, а также может быть причиной снижения иммунитета. Железо (Fe) незаменимо в процессах кроветворения и внутриклеточного обмена: примерно 55% Fe входит в состав гемоглобина эритроцитов; примерно 55% Fe входит в состав гемоглобина эритроцитов около 24% Fe участвует в формировании красящего вещества мышц (миоглобина); примерно 21% Fe откладывается "про запас" в печени и селезенке.
Активный хлор.
Хлор, присутствующий в воде в виде хлорноватистой кислоты (HClO) или гипохлорит-аниона (ClO-), принято называть свободным хлором. Хлор, существующий в виде хлораминов (монохлорамин - NH2Cl и дихлорамин – NHCl2, а также в виде треххлористого азота NCl3) называют связанным хлором.
Свободный (он же активный) хлор достаточно часто применяют для дезинфекции питьевой и сточной воды. В промышленности хлор используют при отбеливании в бумажном производстве, производстве ваты, для уничтожения паразитов в холодильных установках и т.д. При растворении хлора в воде образуются соляная и хлорноватистая кислоты: Cl2 + H2O = H+ + Cl- + HClO.
В питьевой воде содержание активного хлора установлено в пересчете на хлор на уровне 0,3..0,5 мг/л в свободном виде и на уровне 0,8..1,2 мг/л в связанном виде. Активный хлор в указанных концентрациях присутствует в питьевой воде непродолжительное время (не более нескольких десятков минут) и нацело удаляется даже при кратковременном кипячении воды. Анализ отобранной пробы на содержание активного хлора следует проводить немедленно. Лимитирующий показатель вредности для активного хлора – общесанитарный.
Перманганатная окисляемость
Окисляемость – это величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых (при определенных условиях) одним из сильных химических окислителей. Выражается этот параметр в миллиграмм кислорода, необходимого на окисление этих веществ, содержащихся в 1 л воды.
Различают несколько видов окисляемости воды: перманганатную, бихроматную, иодатную, цериевую.
Наиболее высокая степень окисления достигается бихроматным и одатным методами. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах, как правило,
бихроматную окисляемость (называемую также ХПК – «химическое потребление кислорода»). Окисляемость является очень удобным комплексным параметром, позволяющим оценить общее загрязнение воды органическими веществами, в т.ч. микроорганизмами.
Величина окисляемости природных вод может варьироваться в широких пределах от долей миллиграммов до десятков миллиграммов О2 на литр воды. Поверхностные воды имеют более высокую окисляемость (а значит и более "богаты" органикой) по сравнению с подземными. Так, горные реки и озера характеризуются окисляемостью 2..3 мг О2/л, реки равнинные – 5..12 мг О2/л, реки с болотным питанием - десятки миллиграммов на 1 л. Подземные же воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграма О2 /л (исключения составляют воды в районах нефтегазовых месторождений, торфянников, в сильно заболоченных местностях).
Согласно СанПиН 2.1.4.1074-01 (Питьевая вода.) ПДУ перманганатной окисляемости равен 5,0 мг О2 /л. Значение перманганатной окисляемости выше 2 мг О2/л свидетельствует о содержании в воде легкоокисляющихся органических соединений, многие из которых отрицательно влияют на печень, почки, репродуктивную функцию организма.
Аммоний (NH4+, по азоту)
Катионы аммония являются продуктом микробиологического разложения белков животного и растительного происхождения. Образовавшийся таким образом аммоний вновь вовлекается в процесс синтеза белков, участвуя тем самым в биологическом круговороте веществ (цикле азота).
Повышение концентрации ионов аммония и нитритов обычно указывает на свежее загрязнение, в то время как увеличение содержания нитратов — на загрязнение в предшествующее время. Все формы азота, включая и газообразную, способны к взаимным превращениям.
Существует два основных источника загрязнения воды аммонийными соединениями:
- 1. Избыточное и неправильное применения минеральных и органических удобрений;
- 2. Фекалии (стоки с пастбищ и мест скопления скота, сточные воды от животноводческих комплексов, а также разгерметизация систем канализации).
Согласно СанПиН 2.1.4.1074-01 (Питьевая вода.) ПДК аммония составляет 2,0 мг/л. По данным ВОЗ, содержание аммония не должно превышать 0,5 мг/л. Постоянный прием внутрь воды с повышенным содержанием аммония вызывает хронический ацидоз и изменения в тканях. Кроме того, аммиак (в виде газа) раздражает конъюнктиву глаз и слизистые оболочки.
Нитраты (NO3-)
Присутствие нитратных ионов в природных водах связано с:
- 1. внутриводоемными процессами нитрификации аммонийных ионов в присутствии кислорода под действием нитрифицирующих бактерий;
- 2. атмосферными осадками, которые поглощают образующиеся при атмосферных электрических разрядах оксиды азота (концентрация нитратов в атмосферных осадках достигает 0,9 - 1 мг/л);
Концентрация нитратов в поверхностных водах подвержена заметным сезонным колебаниям: минимальная в вегетационный период, она увеличивается осенью и достигает максимума зимой, когда при минимальном потреблении азота происходит разложение органических веществ и переход азота из органических форм в минеральные. Главными процессами, направленными на понижение концентрации нитратов, являются потребление их фитопланктоном и денитрофицирующими бактериями, которые при недостатке кислорода используют кислород нитратов на окисление органических веществ.
В незагрязненных подземных водах содержание нитрат-ионов обычно выражается сотыми, десятыми долями миллиграмма и реже единицами миллиграммов в 1 л. Подземные водоносные горизонты в бóльшей степени подвержены нитратному загрязнению, чем поверхностные водоемы (т.к. отсутствует потребитель нитратов). В незагрязненных поверхностных водах концентрация нитрат-ионов не превышает величины порядка десятков микрограммов в 1 л.
Согласно СанПиН 2.1.4.1074-01 (Питьевая вода.) ПДК нитратов составляет 45 мг/л. При длительном употреблении питьевой воды и пищевых продуктов, содержащих значительные количества нитратов (от 25 до 100 мг/л), резко возрастает концентрация метгемоглобина в крови. Крайне тяжело протекают метгемоглобинемии у грудных детей и у людей, страдающих сердечно-сосудистыми заболеваниями. Особенно в этом случае опасны грунтовые воды и питаемые ими колодцы, поскольку в открытых водоемах нитраты частично потребляются водными растениям. В воздействии на человека различают первичную токсичность собственно нитрат-иона; вторичную, связанную с образованием нитрит-иона, и третичную, обусловленную образованием из нитритов и аминов нитрозаминов. Смертельная доза нитратов для человека составляет 8..15 г; допустимое суточное потребление по рекомендациям ВОЗ — 5 мг/кг массы тела.
Тяжелые металлы
К тяжелым металлам обычно относят элементы периодической системы с атомной массой свыше 50 атомных единиц: Cd, Cu, Cr, Hg, Ni, Pb, Zn, Al, Ag, Au и др. При этом важную роль играют следующие условия: высокая токсичность металла для живых организмов в относительно низких концентрациях, способность к накапливанию в живых организмах и нарастанию концентрации металла в каждом последующем звене пищевой цепи. Ионы металлов всегда присутствуют в природных водоемах.
В зависимости от условий они существуют в различных степенях окисления и входят в состав различных неорганических и металлоорганических соединений, которые могут быть растворенными, коллоидно-дисперсными или входить в состав минеральных и органических взвесей. Многие металлы образуют достаточно устойчивые комплексы с органическими веществами, например с почвенными. Большинство этих комплексов относительно хорошо растворяются в воде в условиях нейтральной, слабокислой и слабощелочной сред, благодаря чему они способны мигрировать в природных водах на значительные расстояния.
Источниками загрязнения водных объектов тяжелыми металлами служат сточные воды гальванических цехов, предприятий горнодобывающей промышленности, черной и цветной металлургии, машиностроительных заводов. Тяжелые металлы входят в состав удобрений и пестицидов и могут попадать в водоемы вместе со стоками сельскохозяйственных угодий.
Повышение концентраций тяжелых металлов в природных водах часто связано с другими видами загрязнений, например, с закислением. Выпадение кислотных осадков способствует снижению рН и переходу металлов из сорбированного (на минеральных и органических носителях) состояния в свободное. Снижение концентраций тяжелых металлов может являться результатом их потребления водными организмами и процессов адсорбции.
Тяжелые металлы способны накапливаться в организме, и достигая определенной концентрации вызывают отравления, мутации. Ионы тяжелых металлов снижая фильтрационную способность почек и печени. Соответственно, это приводит к накоплению токсинов и продуктов жизнедеятельности клеток нашего организма, т.е. самоотравление организма, т.к. именно печень отвечает за переработку ядовитых веществ, попадающих в наш организм, и продуктов жизнедеятельности организма, а почки - за их выведение наружу. Многие из тяжелых металлов обладают канцерогенными свойствами.
Натрий (Na+)
Натрий (Na) участвует в образовании желудочного сока, регулирует выделение почками многих продуктов обмена веществ, активирует ряд ферментов слюнных желез и поджелудочной железы, а также более чем на 30% обеспечивает щелочные резервы плазмы крови. Кроме того, ионы натрия способствуют набуханию коллоидов тканей, что задерживает воду в организме.
Согласно СанПиН 2.1.4.1074-01 (Питьевая вода.) ПДК натрия составляет 200 мг/л.
Марганец (Мn, суммарно)
В природные воды марганец поступает в результате выщелачивания железомарганцевых руд и других минералов, содержащих марганец (пиролюзит, псиломелан, браунит, манганит, черная охра). Значительные количества марганца поступают в окружающую среду в результате разложения водных животных и растительных организмов, особенно сине-зеленых диатомовых водорослей и высших водных растений.
Соединения марганца выносятся в водоемы со сточными водами марганцевых обогатительных фабрик, металлургических заводов, предприятий химической промышленности и др. Роль марганца в жизни высших растений и водорослей весьма важна. Марганец способствует утилизации углекислого газа растениями, повышая эффективность фотосинтеза, участвует в процессе восстановления нитратов и ассимиляции азота растениями.
Согласно СанПиН 2.1.4.1074-01 (Питьевая вода.) ПДК марганца составляет 0,1 мг/л. Избыток марганца способствует частому развитию пневмоний, оказывает нейротоксическое действие (снижается проводимость нервного импульса, как следствие повышается утомляемость, сонливость, снижается быстрота реакции, работоспособность, появляются головокружение, депрессивные, подавленные состояния). В тяжелых случаях может возникать так называемый марганцевый паркинсонизм. Особенно опасны отравления марганцем у детей и эмбрионов (когда женщина беременна) - приводит к идиотии. Из 100 детей, матери которых во время беременности подверглись отравлению марганцем, 96-98 рождаются идиотами.
Однако в разумных дозах марганец полезен. Марганец (Mn) принимает участие в некоторых окислительно-восстановительных процессах, входя в состав ферментов (пероксида и аминофенолоксидазы) в качестве активного центра: активно влияет на обмен белков, углеводов и жиров. В присутствии Mn организм полнее использует жиры, усиливает действие инсулина, способствует поддержанию определенного уровня холестерина в крови.
Фториды (F-)
Важным источником ионов фтора в природных водах служат продукты разрушения горных пород, в состав которых входит апатит Ca5(PO4)3F, турмалин, фосфорит, флюорит. Например, за счет присутствия флюорита в породах каменноугольных отложений Подмосковной впадины, концентрация ионов фтора в подземной воде некоторых районов Подмосковья обнаруживается до 3 мг/л.
В отличие от других галогенов (Cl, Br, I) фтор характеризуется чрезвычайно низкой растворимостью своих кальциевых солей, поэтому содержание фтора в подземных водах лимитируется содержанием кальция. Вследствие высокой растворимости NaF переход фтора из пород в подземные воды и его содержание зависят от соотношения Na/Ca – чем больше это соотношение, тем больше фтора может содержаться в этих водах. В морской воде фтора содержится около 1 мг/л. В некоторых источниках (Аахен) его концентрация равна 31,8 мг/л.
Фтор может добавляться в питьевую воду в целях профилактики заболеваний кариесом. Однако, избыточные количества фтора оказывают вредное воздействие на человека, вызывает разрушение зубной эмали. Кроме того, избыток фтора в организме осаждает кальций, что приводит к нарушениям кальциевого и фосфорного обмена.
Согласно СанПиН 2.1.4.1074-01 (Питьевая вода.) ПДК фторидов составляет 1,5 мг/л.
Ртуть (Нg, суммарно)
Ртуть относится к ультрамикроэлементам и постоянно присутствует в организме, поступая с пищей. Неорганические соединения ртути (в первую очередь катионы Hg+) реагируют с SH–группами белков, а также с карбоксильными и аминными группами тканевых белков, образуя прочные комплексные соединения – металлопротеиды. В результате возникают глубокие нарушения функций центральной нервной системы, особенно высших ее отделов. Из органических соединений ртути наибольшее значение играет метилртуть, которая хорошо растворима в липидных тканях и быстро проникает в жизненно важные органы, и в том числе в мозг.
В результате возникают изменения в вегетативной нервной системе, периферических нервных образованиях, в сердце, сосудах, кроветворных органах, печени, нарушения в иммунобиологическом состоянии организма. Соединения ртути обладают также эмбриотоксическим действиям (приводят к нарушению плода у беременных). ПДК – 0,0005 мг/л. Лимитирующий показатель вредности санитарно- токсикологический.
Согласно СанПиН 2.1.4.1074-01 (Питьевая вода.) ПДК ртути составляет 0,0005 мг/л.
Сульфиды и сероводород
Встречаются в основном в подземных источниках воды, образуясь в результате процессов восстановления и разложения некоторых минеральных солей (гипса, серного колчедана др.). В поверхностных водах сероводород почти не встречается, т.к. легко окисляется. Появление его в поверхностных источниках может быть следствием протекания гнилостных процессов или сброса неочищенных сточных вод. Наличие в воде сероводорода придает ей неприятный запах, интенсифицирует процесс коррозии трубопроводов и вызывает их зарастание вследствие развития серобактерий.
Согласно СанПиН 2.1.4.1074-01 (Питьевая вода.) ПДК сероводорода составляет 0,003 мг/л.
Кремний
Кремний является постоянным компонентом химического состава природных вод. Кремний в природе представлен в виде кислородосодержащих силикатов: от простого кварца (SiO2) до сложных соединений, содержащих щелочные и щёлочноземельные металлы: полевой шпат (K2О×AI2О3×6SiO2), каолин (AI2О3×2SiО2×2H2O).
Этому способствует в отличие от других компонентов повсеместная распространенность соединений кремния в горных породах, и только малая растворимость последних объясняет малое содержание кремния в воде. Главным источником соединений кремния в природных водах являются процессы химического выветривания и растворения кремнийсодержащих минералов, например алюмосиликатов:
KMg3AlSi3O10(OH)2+7H2CO3+½H2O → K++3Mg2++7HCO3--+2H4SiO4+½Al2Si2O5(OH)4.
Значительные количества кремния поступают в природные воды в процессе отмирания наземных и водных растительных организмов, с атмосферными осадками, а также со сточными водами предприятий, производящих керамические, цементные, стекольные изделия, силикатные краски, вяжущие материалы, кремнийорганический каучук и т.д. Формы соединений, в которых находится кремний в растворе, весьма многообразны и меняются в зависимости от минерализации, состава воды и значений рН. Часть кремния находится в истинно растворенном состоянии в виде кремниевой кислоты и поликремниевых кислот:
H4SiO4 ↔ H + H3SiO4-.
Поликремниевые кислоты имеют переменный состав типа mSiO2•nH2O,
где m и n — целые числа.
Кроме того, кремний содержится в природных водах в виде коллоидов типа xSiO2•yH2O.
Сравнительно малое содержание кремния в поверхностных водах, указывает на наличие в воде процессов, уменьшающих его концентрацию. К ним надо отнести потребление кремния водными организмами, многие из которых, например диатомовые водоросли, строят свой скелет из кремния. Кроме того, кремниевая кислота как более слабая вытесняется из раствора угольной кислотой:
Na4SiO4 + 4CO2 + 4H2O = H4SiO4 + 4NaHCO3.
Неустойчивости кремния в растворе способствует и склонность кремниевой кислоты при определенных условиях переходить в гель. Режим кремния в поверхностных водах до некоторой степени сходен с режимом соединений азота и фосфора, однако кремний никогда не лимитирует развитие растительности.
Согласно СанПиН 2.1.4.1074-01 (Питьевая вода.) ПДК кремния равна 10 мг/л. Концентрация кремния в речных водах колеблется обычно от 1 до 20 мг/л; в подземных водах его концентрация может возрастать до 20..30 мг/л, а в горячих термальных водах содержание кремния может достигать сотен миллиграммов в 1 л.
Калий (К+)
Калий необходим для нормальной жизнедеятельности организма, т.к. является компонентом калий-натриевого насоса. Калий-натриевый насос - это структура на мембране каждой клетки, благодаря которой в клетку проникают вещества из межклеточной жидкости, а из клетки выводятся продукты ее жизнедеятельности. Кроме того, особенно важен калий для сердечно-сосудистой деятельности, т.к. он нормализует давление крови и работу сердца.
Содержание Калия не нормируется.
Кадмий (Cd, суммарно)
Соединения кадмия очень ядовиты. Действуют на многие системы организма – органы дыхания и желудочно–кишечный тракт, центральную и периферическую нервные системы. Механизм действия соединений кадмия заключается в угнетении активности ряда ферментов, нарушении фосфорно–кальциевого обмена, нарушении метаболизма микроэлементов (Zn, Cu, Fe, Mn, Se).
Согласно СанПиН 2.1.4.1074-01 (Питьевая вода.) ПДК кадмия составляет 0,001 мг/л, лимитирующий показатель вредности – санитарно-токсикологический.
Микроорганизмы и паразиты
В природных водах присутствуют и размножаются микроорганизмы, водоросли, ракообразные, рыбы, земноводные, в толще воды развиваются личинки комара, на поверхности воды живут водомерки. Многие из этих организмов, называемых гидробионтами, являются опасными для здоровья и жизни человека, например, огромные морские хищники - акулы - или небольшие хищные рыбы пираньи.
Но и небольшие микроорганизмы - микробы - могут нанести непоправимый вред здоровью человека.
В воде могут присутствовать также микроскопические личинки паразитов, амебные цисты, бактерии в споровой форме и другие патогенные формы. Основным источником патогенных организмов, распространяемых водой, являются фекалии человека и теплокровных животных, а также фекально-бытовые сточные воды. Фекальные загрязнения воды ухудшают ее качество, а патогенные микроорганизмы, попадающие в воду с выделениями теплокровных животных и человека, могут явиться причиной заболеваемости кишечными инфекциями.
Среди патогенных микроорганизмов чаще других об¬наруживаются в загрязненных водах сальмонеллы, шигеллы, пастереллы, вибрионы, микобактерии, энтеровирусы человека, амебные цисты, личинки нематод, энтеропатогенные Е.Соli и др.
Бактерии - одноклеточные микроорганизмы, способные к самовоспроизводству. Они подразделяются на две большие подгруппы: аэробные (потребляющие в процессе жизнедеятельности кислород) и анаэробные (не потребляющие кислород). Бактерии могут существовать в широком диапазоне условий окружающей среды. Некоторые, например, pseudomonada, могут процветать в среде с очень низким уровнем питательных веществ.
Эти бактерии являются производителями слизи: главной проблемы для систем подготовки воды. Другие жестко прикрепляются к поверхности, выделяют студенистое вещество. Оно служит защитой бактерий от химических дезинфицирующих средств.
Этот агломерат бактерий и защищающего их студенистого вещества иногда называют биопленкой. Концентрация бактерий в воде обычно выражается в терминах колониеобразующих единиц (cfu) на миллилитр (ml). Колониеобразующая единица - это жизнеспособная бактерия, которая, воспроизводясь, может сформировать целую колонию, если она инкубируется в питательной среде.
Вирусы - внеклеточная форма жизни, состоящая из РНК или ДНК в протеиновой оболочке. Размножается только после проникновения в живую клетку, имеет очень маленькие размеры от 15 до 350 нанометров.
Сальмонеллы (Salmonellа) - это представители рода сальмонелл, в который входит около 2000 различных грамм-отрицательных микроорганизмов, похожих друг на друга по внешнему строению и воздействию на человека. Эти микробы вызывают заболевание желудочно-кишечного тракта, называемое сальмонеллезом. В воде сальмонеллы сохраняются до 120 дней; эффективно дезинфицируются раствором хлорной извести.
Шигеллы (Shigеllа) - это дизентерийные микробы, поражающие от¬дел толстой кишки человека; вызывают дизентерию (шигеллез) с признаками интоксикации. Они хорошо сохраняются в воде и даже могут размножаться. На них губительно действуют высокая температура и дезинфицирующие средства.
Амебные цисты, попадающие в организм человека с загрязненной водой, вызывают амебиаз - болезнь кишечника, иногда осложняющаяся абсцессами печени, головного мозга, поражением Легких и др гих органов. Возбудитель относится к классу простейших (Епtamoeba histolitiса), размер ее может достигать 20-30 мкм.
Лептоспироз - острое инфекционное заболевание, передающееся человеку от животных. Однако возможен и водный путь передачи инфекции. Болезнь характеризуется поражением почек, печени, центральной нервной системы и мышц, сопровождается интоксикацией и лихорадкой. Возбудителем лептоспироза являются лептоспиры (Leptospirа interrogans) - спиралевидные организмы, приспособлений для жизни в воде.
Ежегодная заболеваемость во всем мире составляет 1%, но при контакте с домашними животными вероятность заболеваемости увеличивается. В литературе описана вспышка лептоспироза у 50 человек, которые купались в реке, протекавшей вблизи пастбища для коров и свиней.
В этом ряду инфекционных заболеваний, водный путь возникновения которых является наиболее вероятным, необходимо отметить холеру. Эта болезнь в XIX в. вызывала в Европе пандемии. Заболевания холерой были отмечены в 1947 г. в Египте, в 1964 г. - в Иране и Ираке, в 1970 г. - в Советском Союзе (Одесса и Астрахань). В последние годы вибрионы холеры были обнаружены в водоемах Москвы, Санкт-Петербурга, Тамбова.
Не исключена возможность их появления и в водоемах других регионов России. Распространение холеры связано с нарушениями карантинов, усилением миграции людей - носителей холерного вибриона, а также с перевозкой загрязненных продуктов и воды кораблями и самолетами. Возбудителем холеры являются вибрионы (Vibrio cholerae). Холерный вибрион хорошо переносит низкие температуры и даже замораживание.
При кипячении погибает через 1 мин, при воздействии дезинфицирующих средств - почти сразу.
Некоторые вирусы человека могут передаваться через воду при ее загрязнении фекалиями. К ним относятся возбудители инфекционного гепатита, полиомиелита, энтеровирусных инфекций, вызывающих поражение центральной нервной системы, мышц, миокарда и кожных покровов. Возможность передачи вирусов водным путем можно продемонстрировать на примере вирусного гепатита.
Самая большая вспышка вирусного гепатита отмечена в 1955-1956 гг. в Дели. Несколько тысяч человек были инфицированы в результате употребления воды из централизованной системы водоснабжения. Дело в том, что в природной воде присутствовали возбудители кишечных заболеваний, вирус гепатита и другие патогенные формы. Обработка воды хлорированием привела к подавлению возбудителей кишечных инфекций, но не смогла подавить вирус гепатита.
Этому препятствовала высокая мутность исходной воды: вирусы как бы прятались во взвешенных частицах. В 1996 г. инфицирование вирусным гепатитом при употреблении питьевой воды было отмечено и в России.







